头孢喹肟的特性及其在猪病防治中的应用
- 点击次数:
- 日期:2016-07-01
- 编辑:lily
- 来源:未知
- 评论:0 条
头孢喹肟(Cefquinome,CEQ),又称头孢喹诺,是德国Hoechst Roussel Vet公司开发的第一个动物专用第四代头孢菌素类抗生素,主要用于猪、牛细菌性呼吸道感染、奶牛乳房炎等疾病的治疗。我国农业部也已批准国产头孢喹肟原料及其注射液为国家二类新兽药。头孢喹肟具有抗菌谱广、动物专用、用量少、生物利用度高、疗效显著、残留低和使用安全等优点,在畜禽养殖生产中具有非常广阔的应用前景。
1 理化性质
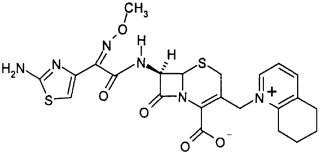
头孢喹肟的分子式为C23H24N6O5S2,分子量为528.60,CAS号为:84957-30-2,为白色或类白色结晶粉末,微溶于水,pH为7.0时的溶解度为11-12mg/mL,高温、潮湿环境中不稳定、易分解,其硫酸盐的干燥粉末较为稳定。其化学结构式见图1。
图1 头孢喹肟的化学结构式
头孢喹肟结构式的特点是:分子中3位上有1个四价氮正电荷,可形成两性离子;7位侧链上的2-氨基噻唑基-乙酰氨基及1个α-氧代亚氨基,由此可以防止酶对母核作用而提高对β-内酰胺酶的稳定性,同时7位上的α碳上大部分被取代后也可减少β-内酰胺酶的接近。
2 作用机理及抗菌活性
头孢喹肟的抗菌作用机理是通过竞争细菌的粘肽合成酶,即青霉素结合蛋白(penicillin binding proteins,PBPs),抑制细胞壁的粘肽合成,造成细菌细胞壁缺损,大量的水分涌进细菌内,使细菌肿胀、破裂、死亡;促发自溶酶活性,使细菌溶解。
由于头孢喹肟在β-内酰胺结构团的C-3位上引进了季铵基侧链,与PBPs结合时,药物分子很快进入细菌体内,使药物在细胞质中达到高的浓度。由于它是一种两性离子化合物,也提高了对细菌周质腔的渗透能力以及与青霉素结合蛋白的结合力,正是这种特殊的分子结构,显示了它对染色体和质粒编码的β-内酰胺酶高度稳定,由于头孢喹肟的杀菌过程发生于细菌细胞的繁殖期,因此为繁殖期杀菌药。细菌细胞有细胞壁,而哺乳动物的细胞无细胞壁,所以头孢喹肟的毒性很低。
头孢喹肟的抗菌谱很广,对大多数革兰氏阳性菌和革兰氏阴性菌都有较强的杀灭作用。尤其对金黄色葡萄球菌、链球菌、绿脓杆菌和大肠杆菌属的成员都有较强的杀菌活性,另外对耐青霉素的葡萄球菌和肠球菌也有较强的抑菌活性,对革兰氏阴性厌氧菌的体外活性有限。
Schimmel等[1]研究了头孢喹肟对呼吸道致病菌的体内和体外抗菌作用,结果显示,头孢喹肟对A型多杀性巴氏杆菌的最小抑菌浓度(MIC)为0.1-1.5µg/mL,B型为15µg/mL,D型为0.1µg/mL,对A型和D型的副猪嗜血杆菌为0.1µg/mL,对猪传染性胸膜肺炎放线杆菌为0.1µg/mL。
Pejsak等[2]从病猪肺及呼吸道中分离的84株链球菌、191株胸膜肺炎放线杆菌、23株霍乱沙门氏菌、1027株多杀性巴氏杆菌、580株埃希氏大肠杆菌,比较了头孢喹肟、阿莫西林和恩诺沙星等药物对这些细菌的抗菌活性。结果表明,96.7%的猪链球菌、97.9%的胸膜肺炎放线杆菌、98.4%的霍乱沙门氏菌、90.0%的多杀性巴氏杆菌和97.9%的埃希氏大肠杆菌对头孢喹肟高度敏感,远高于阿莫西林、恩诺沙星等药物。
范小平等[3]进行了头孢喹肟对金黄色葡萄球菌、大肠杆菌、链球菌、多杀性巴氏杆菌、胸膜肺炎放线杆菌的体外抗菌作用研究。结果显示,头孢喹肟对金黄色葡萄球菌、大肠杆菌、链球菌、多杀性巴氏杆菌、胸膜肺炎放线杆菌的抗菌活性较强,其最小抑菌浓度范围分别为1-2、≤0.031-0.25、≤0.031-0.125、≤0.031-0.5和≤0.031µg/mL。
马全朝等[4]进行了头孢喹肟对临床分离菌株的抗菌活性研究。结果显示,头孢喹肟对金黄色葡萄球菌、链球菌、沙门氏菌和大肠杆菌的MIC50(抑制50%细菌所需的最低抑菌浓度)分别为0.063、0.063、0.032、0.125µg/mL,MIC90(抑制90%细菌所需的最低抑菌浓度)分别为0.125、0.125、0.125和0.25µg/mL;在很小的浓度变化范围内,头孢喹肟能够快速抑菌,在抑菌浓度为1倍或2倍MIC时,24h内能杀灭金黄色葡萄球菌、大肠杆菌或链球菌、沙门氏菌。头孢喹肟对上述几种临床分离细菌具有很强的抑菌效果和杀菌活性。
3 头孢喹肟在猪的药动学特性
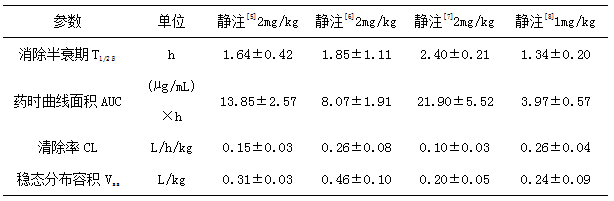
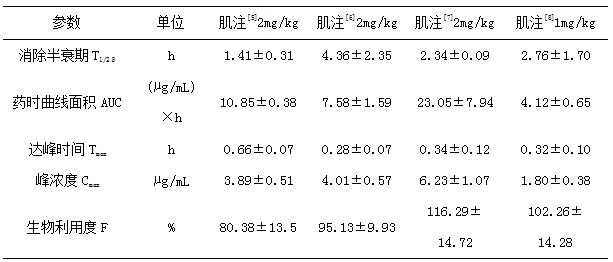
头孢喹肟在猪体内口服吸收很差,主要给药方式为胃肠外给药。肌注吸收迅速,达峰时间短(0.3-0.7h)[5-8],消除快,消除半衰期在1.4-4.4h[5-8],生物利用度高(>80%)[5-8]。静注消除快,消除半衰期为1.3-2.4h[5-8],分布不广泛,稳态分布容积为0.2-0.5L/kg[5-8]。具体药动学参数见表1和2。
European Medicines Agency(EMA)报告[9-10]显示,头孢喹肟为有机酸(酸解离常数-Pka在2.51-2.91之间),其脂溶性比较低,因此其在动物体内分布并不广泛,表现分布容积比较低,在0.2L/kg左右;另外,头孢喹肟与血浆蛋白的结合率也比较低(5-15%)。药物浓度以注射部位、肾脏、肝脏为最高,肌肉次之,脂肪最低。在猪体内,头孢喹肟主要通过肾脏和粪便以原药形式排泄。24h约有83%的原药从尿液排泄,7%从粪便排泄;48h约有86%的原药从尿液排泄,9%从粪便排泄。
表1 猪静注头孢喹肟的药动学参数
表2 猪肌注头孢喹肟的药动学参数
4 毒理学
EMA报告[9]显示,头孢喹肟的急性毒性很低。对狗进行90d的重复剂量毒性研究,剂量为0、3.2、32和320 mg/kg体重,未观察到任何毒性症状;对大鼠进行90d的毒性研究,口服剂量为0、25、250和2500mg/kg体重,出现剂量依懒性的溶血性贫血症状;高剂量组(2500mg/kg)观察到眼球苍白,250mg/kg剂量组的血液和尿液参数发生了变化;仅在250和2500mg/kg体重剂量组,出现剂量依赖性的肾功能损害,血尿素氮(BUN)轻微上升。
大鼠进行了二代生殖毒性研究,口服剂量为0、25、250和2500mg/kg体重,未观察到生殖毒性反应。大鼠和兔进行了致畸性研究,口服剂量分别为0、25、250、2500mg/kg体重和0、0.10、0.32、1.0mg/kg体重,结果表明,头孢喹肟没有潜在的致畸性。头孢喹肟对中国仓鼠细胞的基因突变试验、体内哺乳动物细胞裂解效应(小鼠微核试验)以及体外非常规DNA合成试验,结果均呈阴性。尚未见头孢喹肟致癌性的相关报道。头孢喹肟也没有免疫毒性。
荣俊等[11]进行了国产硫酸头孢喹肟在小鼠的急性毒性和亚慢性毒性研究。急性毒性结果显示,国产硫酸头孢喹肟原料药口服LD50(半数致死量)大于5000mg/kg,按外源化合物急性毒性分级标准判断为无毒物质;对小鼠腹腔注射的LD50为844.03mg/kg,分别是临床应用剂量的400-800倍,说明该药安全范围广,毒性低,使用安全。
小鼠腹腔注射连续4w进行亚慢性毒性研究,结果显示,各组间的体重变化和脏器系数比较无显著性差异(P>0.05);高剂量组(422mg/kg)的红细胞计数和血小板略微下降,但与对照组比较差异不显著(P>0.05);高剂量组的尿素氮和肌酐与对照组比较有升高的趋势,但差异也不显著(P>0.05);高剂量组的肾脏略有变化,肾小囊间隙增大,其余组织未见异常明显变化。说明国产硫酸头孢喹肟对血常规和血清生化指标影响很小。
岳永波等[12]进行了大鼠和小鼠口服硫酸头孢喹肟注射液的急性毒性试验以及猪肌肉注射硫酸头孢喹肟注射液的安全性试验。结果表明,大鼠和小鼠经口LD50均大于5000mg/kg。硫酸头孢喹肟注射液在2-10mg/kg剂量范围对猪血液生理生化指标无显著影响(P>0.05),所有动物给药后采食、行动、呼吸和排泄均未见异常,注射部位未见肿胀结块等现象,除10mg/kg剂量组动物出现短时疼痛反应外,未观察到任何不良反应。
5 头孢喹肟在猪体内的残留
EMA报告[10]显示,在猪进行非放射性标记的头孢喹肟残留消除研究,按推荐的治疗方案给药,即:2mg/kg体重,给药5次,间隔24h,于最后1次剂量后的24、48、72、96、120和144h屠宰动物(每组4头动物)。在24h,所有注射部位和肾脏组织都能够检测到头孢喹肟,浓度范围分别为100-208µg/kg和88-293µg/kg;在48h,所有注射部位的残留浓度高于13µg/kg;在72和96h,分别仅有两个注射部位能够检测到头孢喹肟(其中1个为16和14µg/kg,另1个为20和19µg/kg);在120h,仅有1个注射部位能够检测到(14µg/kg);而在144h,所有注射部位样品都低于定量限。而肾脏样品在48、72和120h均测不到残留物,但在96h,仅有1个样品能够检测到(40µg/kg);肝脏、脂肪、皮肤和肌肉组织(非注射部位)均没有检测到头孢喹肟(除了72h的1个脂肪组织外,浓度为27µg/kg)。
Zhang等[13]进行了硫酸头孢喹肟在猪的残留消除研究。2mg/kg的剂量肌肉注射,每天1次,连续5d,于最后1次给药后的0.5、1、2、3、5、7、9d屠宰动物,用高效液相色谱-紫外法(HPLC-UV)测定不同组织中头孢喹肟的残留浓度。结果显示,肾脏组织的残留量最高;停药后0.5d,肾脏和肝脏组织可检测到头孢喹肟残留,浓度范围为602-952ng/g和219-392ng/g;停药后3d,肾脏组织残留量为20-28ng/g,肝脏组织为23-26ng/g,在后面的时间点,肾脏和肝脏组织均测不到头孢喹肟;在所有时间点,肌肉和脂肪组织均检测不到头孢喹肟。推荐的休药期为3d。
刘利锋等[14]进行了硫酸头孢喹肟注射液在猪组织中的残留研究。以2mg/kg的剂量肌肉注射,连续5d,于最后1次给药后测定不同组织中头孢喹肟的浓度。结果表明,停药后各组织中头孢喹肟浓度逐渐下降;给药后1d,所有组织均可检测到头孢喹肟,肌肉、肝脏、肾脏、肺脏、皮肤+脂肪大约为207、256、262、103、80µg/kg;给药后2d,仅有1个脂肪+皮肤样品检测不到,肌肉、肝脏、肾脏、肺脏、皮肤+脂肪大约为72、91、136、52、31µg/kg;给药后3d,肌肉和肺脏中分别有1个和2个样品降至检测限以下,肌肉、肝脏、肾脏、肺脏、皮肤+脂肪大约为32、42、76、32、23µg/kg;给药后4d,肺脏、脂肪+皮肤中已经检测不到头孢喹肟,肌肉、肝脏、肾脏大约为27、26、27µg/kg;给药后5d,所有组织均检测不到头孢喹肟。
徐向明等[15]进行了国产头孢喹肟注射液在猪组织中的残留消除研究。健康猪按2mg/kg剂量肌肉注射头孢喹肟注射液,每日1次,连续5d,最后一次给药后0.5、1、2、3、5、7、9d分别宰杀5头猪,采集肌肉、脂肪、肝脏和肾脏,测定组织中头孢喹肟残留量。结果显示,头孢喹肟在肌肉和脂肪中消除较快,在肝脏和肾脏中消除较慢,且残留浓度远高于肌肉和脂肪,说明头孢喹肟在猪体内的分布是不均匀的,主要经肝脏和肾脏消除,提示肾脏和肝脏为头孢喹肟在猪体内残留的靶组织。
EMA[10]规定了头孢喹肟在猪各组织的最大残留限量,肌肉为50µg/kg,肝脏为100µg/kg,肾脏为200µg/kg,皮肤+脂肪为50µg/kg,残留标示物为头孢喹肟,见表3。基质固相分散/高效液相色谱-二极管阵列分析方法可用于测定肾脏、肌肉、脂肪和肝脏组织中的头孢喹肟残留,检测限和定量限分别为:肌肉11和25µg/kg,肝脏13和60µg/kg,肾脏35和80µg/kg,脂肪14和25µg/kg。
表3 头孢喹肟在猪组织的最大残留限量(MRL)
6 头孢喹肟在猪病防治中的应用
岳永波等[16]进行了硫酸头孢喹肟治疗猪细菌性呼吸道病的疗效试验。选取试验猪只100头以上,均有不同程度的呼吸道症状。细菌学分离鉴定,能分离到多杀性巴氏杆菌和/或胸膜肺炎放线杆菌。给药后2d,试验猪的发病症状开始明显减轻;给药后7d,高(3mg/kg)、中(2mg/kg)剂量组猪的病症基本消失,直肠温度均低于40℃;低剂量组(1mg/kg)猪的病症到给药后14d基本消失;而空白对照组大多病症加重。各给药组猪的死亡率明显低于空白对照组(P<0.05),其中高、中剂量硫酸头孢喹肟注射液和对照药物组(头孢噻呋钠4mg/kg)猪的死亡率分别为4.3%、9.1%和4.8%,明显低于低剂量硫酸头孢喹肟注射液组(P<0.05)。试验期内各给药组猪的增重均明显高于空白对照组(P<0.05),而各给药组之间的增重率无明显差异(P>0.05)。试验结果表明,硫酸头孢喹肟注射液能有效地控制猪胸膜肺炎放线杆菌和多杀性巴氏杆菌感染,降低死亡率,提高存活猪的增重,其治疗效果与注射用头孢噻呋钠相当。
王敬等[17]进行了硫酸头孢喹肟对仔猪黄白痢的临床疗效试验。选用自然感染黄白痢患病仔猪为试验对象,以头孢噻呋钠为对照药物。试验结果显示,硫酸头孢喹肟高(3mg/kg)、中(2mg/kg)、低(1mg/kg)剂量组对仔猪黄白痢的治愈率分别为93.3%、90.0%、0%,总有效率分别为100%、100%和6.7%;对照组头孢噻呋钠(5mg/kg)的治愈率为40%,总有效率为60%;硫酸头孢喹肟高、中剂量组对仔猪黄白痢的治愈率与对照药物相比差异极显著(P<0.01)。
周德刚等[18]进行了硫酸头孢喹肟注射液对仔猪传染性胸膜肺炎的临床疗效试验。采用人工发病的方式,将猪胸膜肺炎放线杆菌接种于健康仔猪。接种后2-6d,猪逐渐表现为精神沉郁、食欲降低、体温升高、呼吸困难等临床症状。随后分别给予高(4mg/kg)、中(2mg/kg)、低(1mg/kg)剂量的硫酸头孢喹肟注射液,观察治疗效果。结果表明,硫酸头孢喹肟注射液3个剂量组和阳性对照组(头孢噻呋冻干粉)对仔猪传染性胸膜肺炎均有明显的治疗效果,有效率及相对增重率显著高于阴性对照组(P<0.01);硫酸头孢喹肟注射液高、中剂量组的有效率及相对增重率显著高于硫酸头孢喹肟注射液低剂量组和阳性对照组(P<0.01)。
刘兴金等[19]进行了硫酸头孢喹肟注射液对仔猪大肠杆菌病的疗效试验。采用人工感染发病的方式,将猪大肠杆菌强毒株接种于仔猪。接种后1-5d,猪表现为食欲减少,体温升高,拉稀等临床症状。随后分别给予高(4mg/kg)、中(2mg/kg)、低(1mg/kg)剂量的硫酸头孢喹肟注射液,观察治疗效果。结果表明,硫酸头孢喹肟注射液高、中、低和药物对照组(头孢噻呋冻干粉)对人工感染诱发大肠杆菌病猪的有效率与阳性对照组比较差异极显著(P<0.01);高、中剂量组的有效率极显著高于药物对照组和低剂量组(P<0.01);高、中剂量组间的有效率无显著统计学差异(P>0.05)。硫酸头孢喹肟注射液高、中、低和药物对照组对人工感染诱发大肠杆菌病猪的相对增重率与阳性对照组比较差异极显著(P<0.01);高、中剂量组的相对增重率极显著高于头孢噻呋注射液组和低剂量组(P<0.01);高、中剂量组间的相对增重率无显著统计学差异(P>0.05)。
赵建乐等[20]进行了硫酸头孢喹肟(2mg/kg)对副猪嗜血杆菌病的治疗效果研究。选用自然感染副猪嗜血杆菌的40日龄左右的发病仔猪,给予硫酸头孢喹肟注射液治疗,观察治疗效果。试验结果表明,硫酸头孢喹肟注射液对副猪嗜血杆菌病发病猪群有较高的治愈率(91%),并且治愈后复发率较低(3.2%),可以有效防治副猪嗜血杆菌感染。
Lang 等[21]报道对212头呼吸道疾病的猪只进行治疗,结果表明,头孢喹肟2mg/kg体重,肌肉注射,每天1次,连续2d,治愈率达64.6%,显著高于头孢噻呋对照组。
Lohr等[22]报道了头孢喹肟(2mg/kg)对猪乳房炎-子宫炎-无乳综合症、呼吸道疾病及皮肤病的治疗效果,结果表明治愈率均为98%,其中94%的治疗效果较好。
Heinritzi等[23]研究了头孢喹肟(1、2或4 mg/kg)和阿莫西林(7mg/kg)对母猪毒血症和败血症的治疗效果,结果显示,2、4mg/kg头孢喹肟剂量组治疗效果明显好于7mg/kg阿莫西林剂量组以及1mg/kg头孢喹肟剂量组。
Thomas等[24]研究了头孢喹肟(2mg/kg)和阿莫西林(7.5mg/kg)对110头由链球菌引起细菌性脑膜炎的断奶仔猪的治疗效果,结果显示,治愈率分别为67%和58%,死亡率分别为24%和33%。表明,头孢喹肟的治疗效果好于阿莫西林。
Sachimmel等[25]报道了头孢喹肟对300头仔猪呼吸系统感染的预防效果,在仔猪出生后第18、19、20d各给药1次(1mg/kg,皮下注射),断奶后第42、43、44d各给药1次,可以有效的防治溶血性巴氏杆菌、多杀性巴氏杆菌引起的仔猪呼吸系统感染。
Rose等[26]研究了头孢喹肟(2mg/kg)、阿莫西林(7.5mg/kg)以及恩诺沙星(2mg/kg)对猪呼吸系统感染的疗效对比,结果显示,治愈率分别为90.5%、80.3%、83.1%,表明头孢喹肟的治疗效果好于其他2种药物。
Lohlein等[27]研究了头孢喹肟(2 mg/kg)和阿莫西林(7.5 mg/kg)连续肌注3-5d对113头猪渗出性表皮炎的疗效对比,结果表明,治愈率分别为83.7%、69.8%,头孢喹肟的治疗效果显著优于阿莫西林。
兽医临床上用于防治猪的细菌性呼吸道疾病时,推荐的最佳给药剂量为2mg/kg体重,颈部肌肉注射,每天1次,连续3-5d。
参考文献:
[1] Schimmel D, Erler W, Seeger K, et al. In vitro and in vivo efficacy of Cobactan on respiratory disease agents[C]. Proceedings, International Pig Veterinary Society, 11th Congress, July 1-5, 1990, Lausanne, Switzerland. Swiss Association of Swine Medicine, 1990, 191.
[2] Pejsak Z, Kolodziejczyk P. Incidence and drug sensitivity of bacteria isolated from diseased lungs in pigs[J]. Medycyna Weterynaryjna, 2001, 57(7): 480-485.
[3] 范小平, 杨芳, 赵安良, 等. 硫酸头孢喹肟的体外抗菌作用[J]. 畜牧与兽医, 2008, 40(7): 78-80.
[4] 马全朝, 顾欣, 张可煜, 等. 头孢喹诺对临床分离菌株抗菌活性研究[J]. 中国畜牧兽医, 2009, 36(6): 38-41.
[5] Liu B, Zhang C, Zhang X, et al. Pharmacokinetics and bioavailability of cefquinome in crossbred wild boars[J]. Journal of veterinary pharmacology and therapeutics, 2012, 35(6): 611-614.
[6] Li XB, Wu WX, Su D, et al. Pharmacokinetics and bioavailability of cefquinome in healthy piglets[J]. Journal of veterinary pharmacology and therapeutics, 2008, 31(6): 523-527.
[7] Zhang BX, Lu XX, Gu XY, et al. Pharmacokinetics and ex vivo pharmacodynamics of cefquinome in porcine serum and tissue cage fluids[J]. The Veterinary Journal, 2014, 199(3): 399-405.
[8] 杨大伟, 陈杖榴, 丁焕中, 等. 头孢喹肟在猪体内的药动学及生物利用度[J]. 中国兽医学报, 2009 (9): 1182-1185.
[9] European Medicines Agency, Committee for Veterinary Medicinal Products, Cefquinome, Summary Report.http://www.ema.europa.eu/docs/en_GB/document_library/Maximum_Residue_Limits_-_Report/2009/11/WC500011877.pdf
[10] European Medicines Agency, Committee for Veterinary Medicinal Products, Cefquinome, Summary Report(1).http://www.ema.europa.eu/docs/en_GB/document_library/Maximum_Residue_Limits_-_Report/2009/11/WC500011888.pdf
[11] 荣俊, 李英霞, 张雨菡, 等. 国产硫酸头孢喹肟的急性毒性和亚慢性毒性研究[J]. 江苏农业科学, 2008, 05: 206-209.
[12] 岳永波, 吴好庭, 杨国辉, 等. 猪肌肉注射硫酸头孢喹肟注射液的安全性试验[J]. 畜牧与兽医, 2008, 40(6): 76-78.
[13] Zhang X, Li J, Jiang H, et al. Residue depletion of cefquinome in swine tissues after intramuscular administration[J]. Journal of agricultural and food chemistry, 2007, 55(25): 10493-10498.
[14] 刘利锋, 覃少华, 赵杰, 等. 猪组织中硫酸头孢喹肟含量测定和肌注给药残留研究[J]. 甘肃农业大学学报, 2008, 43(2): 1-7.
[15] 徐向明, 杨海峰, 金礼琴, 等. 头孢喹肟注射液在猪组织中的残留消除研究[J]. 江苏农业科学, 2009 (6): 193-195.
[16] 岳永波, 杨芳, 范小平. 硫酸头孢喹肟治疗猪细菌性呼吸道病的疗效试验[J]. 中国兽医杂志, 2008, 44(7): 45-47.
[17] 王敬, 程文超, 向邦全, 等. 硫酸头孢喹肟对仔猪黄白痢临床疗效试验[J]. 湖北畜牧兽医, 2012, 06: 7-8.
[18] 周德刚, 郭亚楠, 杜向党. 硫酸头孢喹肟注射液对仔猪传染性胸膜肺炎的临床疗效试验[J]. 中国兽药杂志, 2013, 47(10): 27-29.
[19] 刘兴金, 张晓会, 马遂营, 等. 硫酸头孢喹肟注射液对仔猪大肠杆菌病的疗效实验[J]. 国外畜牧学: 猪与禽, 2009, 29 (2): 64-65.
[20] 赵建乐, 徐兆强, 尤永君, 等. 倍诺林对副猪嗜血杆菌病的治疗效果研究[J]. 养猪, 2012, 04: 112.
[21] Lang I, Rose M, Thomas E, et al. A field study of cefquinome for the treatment of pigs with respiratory disease[J]. Revue de Medecine Veterinaire, 2002, 153(8-9): 575-580.
[22] Lohr B, Brunner B, Hellmann K. Survey of the use of Cobactan (R) 2.5% in veterinary practice: Pigs[J]. Tierarztliche Umschau, 2004, 59(6): 356-358.
[23] Heinritzi K, Hagn J. Studies on the efficacy and safety of the new cephalosporin cefquinome in sows with puerperal septicaemia and toxaemia syndrome[J]. Tierarztliche Praxis Ausgabe G, Grosstiere/Nutztiere, 1999, 27(2): 114-121.
[24] Thomas E, Martin G, Voss B, et al. A comparative field study of the efficacy of cefquinome and amoxycillin against acute meningitis of weaned piglets[J]. The Pig Journal, 2002, 50: 28-41.
[25] Schimmel D. Possibilities for the establishment of pneumonia-free swine herds by immunization and administration of cefquinome[J]. Berliner und Munchener tierarztliche Wochenschrift, 1992, 105(11): 378-380.
[26] Rose M, Wissler R, Zschiesche E, et al. Efficacy and tolerance of a new cephalosporin, cefquinome, formulation for treatment of bacterial respiratory diseases of pigs[J]. Tierärztliche Praxis. Ausgabe G, Grosstiere/Nutztiere, 2000, 28(6): 331-336.
[27] Lohlein W, Radeloff I, Wolf O, et al. Efficacy of Cefquinome (Cobactan 2.5% i.m.) for the treatment of porcine exudative epidermitis. Tierarztliche Umschau, 2002, 57(7): 367-374






 黄小建会长下企业调
黄小建会长下企业调 新版 《新建兽用生
新版 《新建兽用生 5项(个)兽药技术
5项(个)兽药技术 农业部发布兽药中非
农业部发布兽药中非